Pęcherzyca zwykła występuje z częstotliwością 1-5 przypadków/milion rocznie i dotyczy głównie osób w średnim wieku – tak samo mężczyzn, jak i kobiet [1, 2]. Jest to najczęstsza odmiana pęcherzycy w Ameryce Północnej i w Europie. Dotyka głównie mieszkańców basenu Morza Śródziemnego. Jej przyczyną są autoprzeciwciała skierowane przeciwko desmogleinom. Charakteryzuje się powstawaniem śródnaskórkowych pęcherzy w obrębie skóry i błon śluzowych, które ulegają rozerwaniu, pozostawiając nadżerki. Potwierdzeniem choroby jest badanie immunofluorescencyjne. Przebieg jest przewlekły i nawrotowy. Dawniej była to choroba śmiertelna, a przyczynami zgonu były przede wszystkim zakażenia, niedożywienie, odwodnienie. W stosowanej obecnie farmakoterapii kortykosteroidami ogólnymi rokowania są bardziej optymistyczne, jednak skutki uboczne stosowanych leków niekorzystnie odbijają się na stanie ogólnym pacjentów [2].
Pęcherzyca jest chorobą autoimmunologiczną. Charakteryzuje się występowaniem przeciwciał przeciwko desmogleinie 3, a następnie desmogleinie 1, w wyniku czego dochodzi do utraty połączeń między keratynocytami. Akantoliza powoduje powstawanie pęcherzy, a po ich przerwaniu – nadżerek. Poziom przeciwciał odzwierciedla przebieg choroby i rokowanie [1].
Przyczynami pęcherzycy są zarówno czynniki genetyczne, jak i czynniki środowiskowe. Często te dwie składowe występują współzależnie, odpowiednio nasilając lub zmniejszając objawy choroby. Do czynników zewnętrznych zaliczamy: czynniki fizyczne (promieniowanie jonizujące, promieniowanie UV), składniki pokarmowe (herbata, czerwone wino, por, cebula, czosnek, chili, pieprz), leki (fenylobutazon, penicylamina, kaptopryl), używki, stres, pestycydy, infekcje wirusowe [3]. Istotną informacją jest to, że każdy typ pęcherzycy mogą wywoływać leki z każdej grupy.
Przeprowadzono badania, które wykazały znacznie większą częstotliwość występowania chorób autoimmunologicznych u pacjentów pierwszego stopnia pokrewieństwa [4]. Są to między innymi: reumatoidalne zapalenie stawów, autoimmunologiczne zapalenie wątroby, toczeń rumieniowy, a także bardzo często choroby tarczycy (najczęściej choroba Haschimoto), dlatego nawet przy braku objawów klinicznych u pacjenta z pęcherzycą zaleca się przeprowadzenie oceny czynności tarczycy i badań laboratoryjnych na obecność przeciwciał przeciwtarczycowych [5].
Objawy
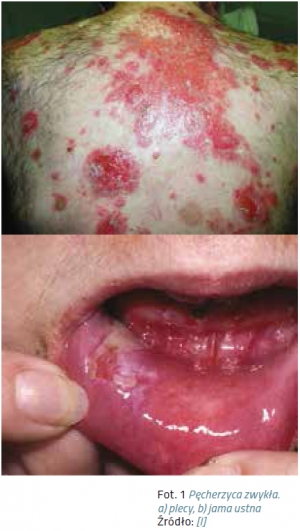
Wykwitem pierwotnym są delikatne pęcherze, łatwo ulegają przerwaniu, co powoduje powstawanie bolesnych nadżerek. Zmiany skórne, mające tendencję do szerzenia się obwodowo, lokalizują się głównie na owłosionej skórze głowy, twarzy oraz w miejscach drażnionych mechanicznie, takich jak: łokcie, kolana, plecy, pośladki. Zawsze należy sprawdzić stan owłosionej skóry głowy.
Przebieg choroby jest przewlekły, bezgorączkowy. Świąd raczej nie występuje [2].
U pacjentów z pęcherzycą dochodzi do powstawania zmian na błonach śluzowych. Są to głównie pęcherze i pęcherzyki, które łatwo ulegają rozerwaniu, doprowadzając do powstania nadżerek – czerwonych z białą otoczką. Występują najczęściej w jamie ustnej, gardle, krtani, gdzie wywołują ból i problemy z jedzeniem, ale także w nosie i na narządach płciowych.
Często są to pierwsze, a niekiedy jedyne manifestacje schorzenia. Zdarza się, że pozostają po zastosowanym leczeniu, pomimo ustąpienia zmian na skórze [6].
Odmianą pęcherzycy zwykłej są: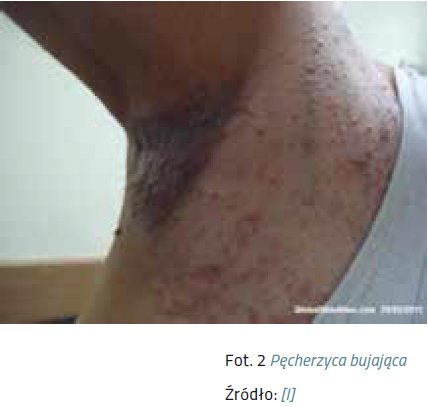
- Pecherzyca bujająca (pemphigus vegetans) – cechująca się występowaniem brodawkujących, przerosłych ognisk w obrębie fałdów skórnych, pachwin i okolic otworów naturalnych ciała, obok wykwitów typowych dla pęcherzycy zwykłej w jej typowej odmianie.
Można wyróżnić jej dwa typy:
- Neumanna, gdzie na podłożu pęcherzycy zwykłej powstaje zmacerowany nalot na zmianach skórnych,
- Hallopeou, zlokalizowana w miejscach wyprzeniowych, rozpoczynająca się krostami przekształcającymi się w bujające zmiany [1].
Zarówno diagnostyka, jak i leczenie wyglądają tak samo jak w pęcherzycy zwykłej [2].
- Pęcherzyca opryszczkowata (pemphigus herpetiformis).
Zmiany rumieniowo-pęcherzykowe występują w układzie opryszczkowatym (kolisty lub obrączkowaty kształt wykwitów).
- Pęcherzyca brazylijska (fogo selvagem). Endemicznie występuje w Ameryce Południowej, ma związek z wirusami i jest przenoszona przez ukłucia owadów.
Diagnostyka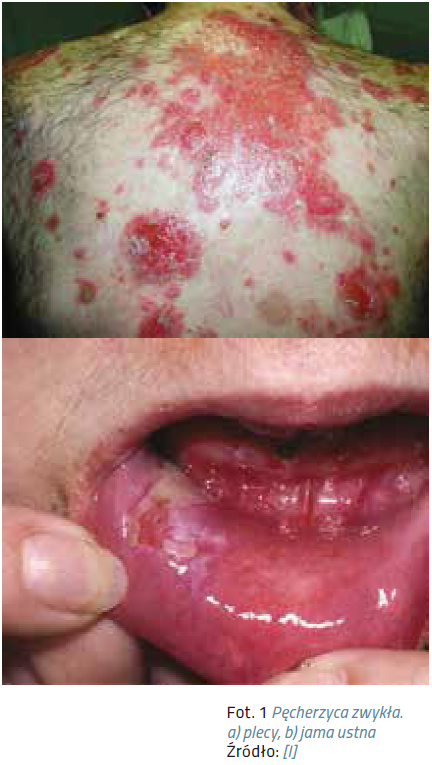
- Badanie przedmiotowe – dodatni bezpośredni objaw Nikolskiego w aktywnym okresie choroby. Pod wpływem pocierania pęcherza następuje spełzanie warstw powierzchownych naskórka. Drugim jest objaw Asboe-Hansena, w którym nienaruszony pęcherz uciśnięty delikatnie palcem szerzy się obwodowo.
- Ocena histologiczna wyciętego małego pęcherza lub brzeg dużego pęcherza – widoczna jest akantoliza.
- Immunofluorescencja bezpośrednia bioptatu zdrowej skóry przylegającej bezpośrednio do pęcherza lub z bardzo wczesnej zmiany (rumień, bąbel pokrzywkowy) – wykazuje śródnaskórkowe złogi IgG.
Badanie surowicy na obecność przeciwciał pemphigus lub wykazanie obecności przeciwciał skierowanych przeciwko antygenowi 130 kD testem immunoenzymatycznym ELISA (enzyme-linked immunosorbent assai).
Pęcherzycę zwykłą należy głównie różnicować z pemfigoidem. Zmiany skórne w pemfigoidzie są wielopostaciowe: rumieniowo-obrzękowe, pokrzywkowate, pęcherzowe i pęcherzykowe. Pęcherze są bardziej napięte, trudne do przerwania, występują na podłożu rumieniowym lub na skórze pozornie niezmienionej chorobowo. Często towarzyszy świąd. Inna jest również lokalizacja: zmiany mogą być rozsiane po całej skórze. Rozstrzygające jest badanie immunopatologiczne [7]. Wykwity na błonach śluzowych jamy ustnej są równie częste w innych schorzeniach, takich jak między innymi: opryszczka zwykła, ospa wietrzna, zakażenie drożdżakowe, afty, liszaj płaski, przewlekłe wrzodziejące zapalenie jamy ustnej, rogowacenie białe (leukoplakia), toczeń rumieniowaty błon śluzowych - dlatego w różnicowaniu tak ważny jest cały obraz kliniczny choroby [11].
Leczenie ogólne
Podstawą terapii są kortykosteroidy. Mogą być podawane doustnie lub w iniekcjach. Rozpoczynamy od dużych dawek i kontynuujemy terapię do chwili, gdy przez tydzień nie pojawią się nowe pęcherze, a 80% starych ulegnie wyleczeniu. Następnie dawka jest redukowana [2]. Kortykosteroidy stosowane przez dłuższy czas lub w dużych dawkach mogą powodować poważne skutki uboczne, w tym: obrzęki, nadciśnienie tętnicze, wzrost masy ciała, złą tolerancję węglowodanów, zwiększoną podatność na zakażenia, chorobę wrzodową, osteoporozę, zaburzenia psychiczne i wiele innych [8]. Bezwzględne przeciwwskazania do terapii glikokortykosteroidami to: psychozy, zakażenia, choroba wrzodowa, osteoporoza, jaskra, zakrzepy
i zatory [8]. Przed kuracją należy przeprowadzić badania w kierunku osteoporozy i gruźlicy utajonej [1].
Najbardziej właściwa wydaje się terapia skojarzona pulsów leków immunosupresyjnych w wysokich dawkach (cyklofosfamid, azatopiryna, metotreksat) z glikokortykosteroidami. Leczenie takie powinno trwać kilka tygodni, aż do momentu poprawy stanu klinicznego i parametrów immunologicznych. Cała kuracja powinna się odbywać pod stałą kontrolą parametrów serologicznych. Bezwzględne przeciwwskazania do stosowania leków immunosupresyjnych to: niewydolność wątroby oraz
wrodzone i nabyte niedobory odporności [7].
W szczególnych przypadkach, gdy pacjent wykazuje oporność na standardowe leczenie, podaje się dożylne wlewy immunoglobulin [2].
Zastosowanie w leczeniu pęcherzycy zwykłej ze względu na obecność przeciwciał znalazła również plazmafereza. Jest przydatna u pacjentów z pęcherzycą zwykłą, którzy nie reagują na standardowe leczenie lub którzy wymagają zbyt wysokich dawek sterydów i leków immunosupresyjnych [9].
Leczenie miejscowe
Główny schemat leczenia miejscowego to jednoczesne stosowanie leków odkażających, glikokortykosteroidów, antybiotyków oraz leków przeciwgrzybiczych. Wszystkie te składniki stosowane są w postaci kremów, maści, aerozolów. Należy przy tym zaznaczyć, że antybiotyki powinno się stosować w przypadku zakażenia, a nie jako element profilaktyki, z uwagi na szybko rozwijającą się lekooporność. Jednocześnie należy unikać stosowania glikokortykosteroidów w obrębie twarzy, co grozi licznymi powikłaniami [10].
Podsumowanie
Pęcherzyca zwykła ma różne oblicza kliniczne, inny przebieg i rokowanie. Leczeniem pęcherzycy zwykłej powinien zająć się doświadczony specjalista. Wynik zadowalającej terapii to ustąpienie objawów klinicznych, a także nieobecność wskaźników immunologicznych w surowicy krwi pacjenta. Pęcherzyca rzadko jest chorobą śmiertelną, ale niestety długotrwałą, uciążliwą, odbijającą się na życiu człowieka. Często osoby chore wymagają opieki psychologa. Niezwykle ważna jest profilaktyka. O ile nie da się uniknąć wystąpienia symptomów choroby, o tyle stosując odpowiednie środki ostrożności można zredukować jej skutki oraz wydłużyć okres remisji. Ważnym zagadnieniem jest unikanie czynników wywołujących fazę aktywną, przede wszystkim stosowanie bezpiecznych leków, należy chronić ciało przed promieniowaniem UV, stosując odpowiednie filtry, odzież ochronną i nakrycia głowy. Nie należy również zapominać o pozostaniu pod kontrolą specjalisty w przypadku współistnienia innych chorób autoimmunologicznych oraz skutecznej kontroli choroby.
Literatura
1. W. Sterry, R. Paus, W. Burgdorf: Dermatologia, Wyd. Czelej Sp. z o.o., Lublin 2009, 169-171.
2. W.H.C. Burgdorf, G. Plwig, H.H. Wolff, M. Landthaler: Braun-Falco Dermatologia, Wyd. Czelej Sp. z o.o., Lublin 2010, 664-668.
3. http://www.ncbi.nlm.nih.gov.pubmed.han.bg.umed.wroc.pl/pubmed/23806154 [PubMed].
4. http://www.ncbi.nlm.nih.gov.pubmed.han.bg.umed.wroc.pl/pubmed/8077468 [PubMed].
5. http://www.ncbi.nlm.nih.gov.pubmed.han.bg.umed.wroc.pl/mc/articles/PMC3478722/ [PubMed].
6. C. Scully: Choroby jamy ustnej diagnostyka i leczenie, Wyd. Medyczne Urban & Partner Wrocław 2006, 389-396.
7. S. Jabłońska, S. Majewski: Choroby skóry i choroby przenoszone drogą płciową, Wyd. Lekarskie PZWL, Warszawa 2005, 2006, 2008, s. 239-240.
8. G. Herold, i in.: Medycyna wewnętrzna. Repetytorium dla studentów medycyny i lekarzy, Wyd. Lekarskie PZWL, Warszawa, 931.
9. http://www.ncbi.nlm.nih.gov/pubmed/11100023 [PubMed].
10. J. Szepietowski, i in.: Leczenie chorób skóry I chorób przenoszonych drogą płciową, Wyd. Lekarskie PZWL, Warszawa 2002, 217-221.
11. http://leczenie-objawy.pl/zmiany-skorne-na-blonach-sluzowych.htm.
Źródła fotografii
I. http://www.medicalsubstance.com
II. http://www.wikipedia.org
Źródło: http://kosmetologiaestetyczna.com/

























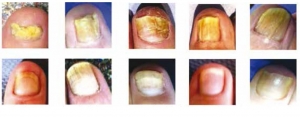
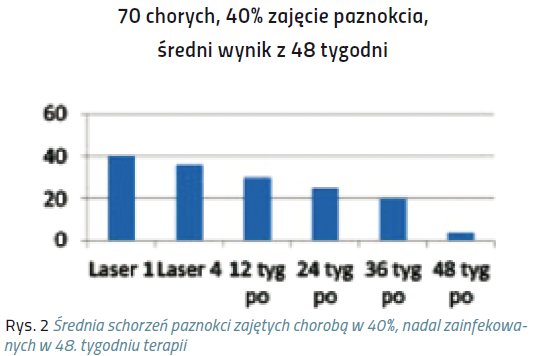
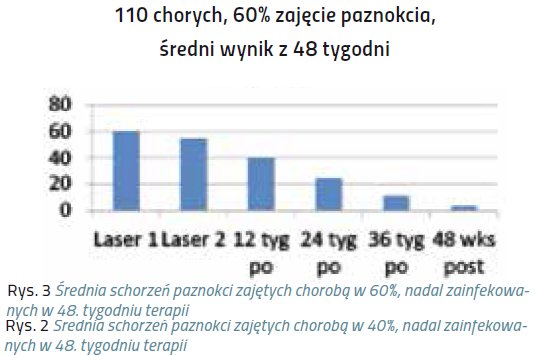
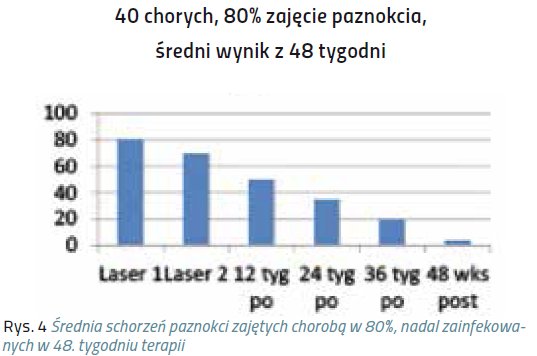
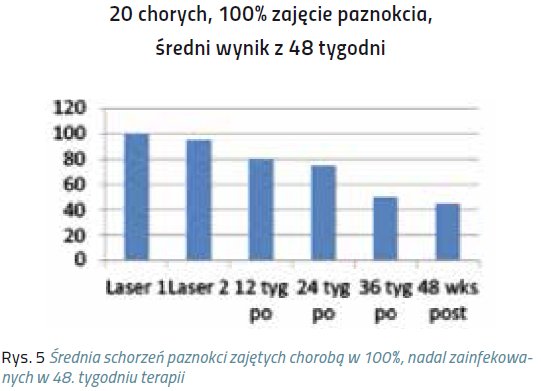
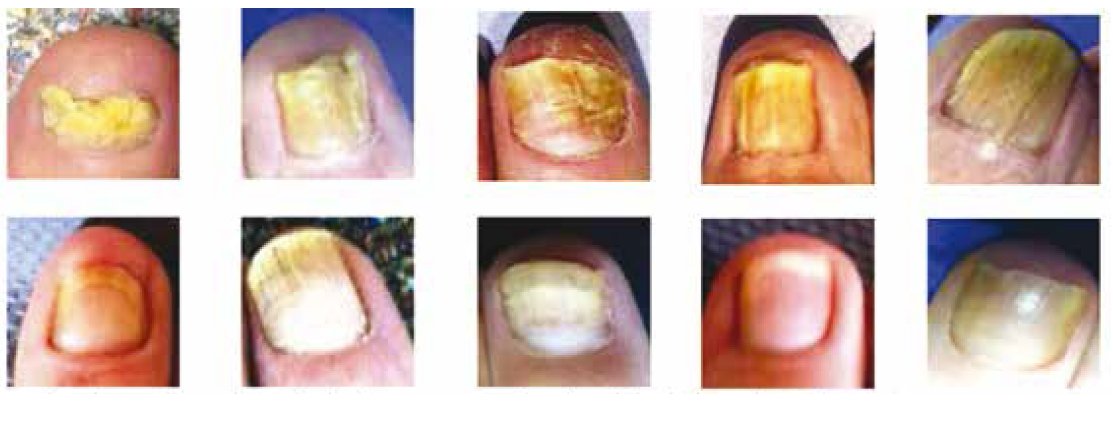 Niniejsze doniesienie jest raportem wstępnym z próby klinicznej, mającej na celu ocenę skuteczności laseroterapii w terapii grzybicy paznokci. Badaniem została objęta grupa 320 chorych, zarówno mężczyzn, jak i kobiet, w wieku średnio 40 lat.
Niniejsze doniesienie jest raportem wstępnym z próby klinicznej, mającej na celu ocenę skuteczności laseroterapii w terapii grzybicy paznokci. Badaniem została objęta grupa 320 chorych, zarówno mężczyzn, jak i kobiet, w wieku średnio 40 lat.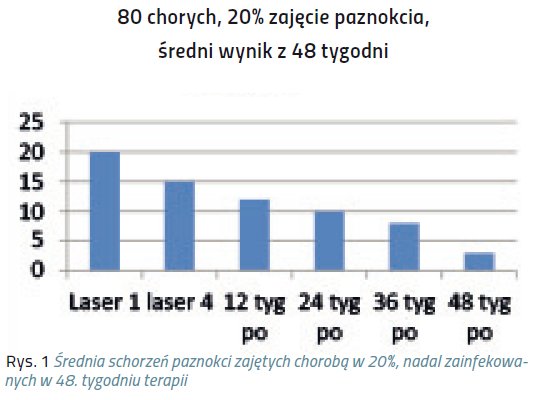

 Wakacje dobiegają końca, ludzie wracają ze swoich urlopów. Nadal cieszymy się piękną opalenizną. Z pewnością, wiele osób uległo poparzeniom słonecznym w trakcie swojego wypoczynku. Można mieć wrażenie, że skoro skóra przestała się czerwienić, zapomnieliśmy o bólu i pieczeniu, to uszkodzenie skóry ustąpiło wraz z nimi. Nic bardziej mylnego. Pamiątka po poparzeniu zostanie z nami na zawsze, ponieważ komórki skóry przechowują DNA pamięć działania promieni słonecznych.
Wakacje dobiegają końca, ludzie wracają ze swoich urlopów. Nadal cieszymy się piękną opalenizną. Z pewnością, wiele osób uległo poparzeniom słonecznym w trakcie swojego wypoczynku. Można mieć wrażenie, że skoro skóra przestała się czerwienić, zapomnieliśmy o bólu i pieczeniu, to uszkodzenie skóry ustąpiło wraz z nimi. Nic bardziej mylnego. Pamiątka po poparzeniu zostanie z nami na zawsze, ponieważ komórki skóry przechowują DNA pamięć działania promieni słonecznych.
 Karmienie piersią jest promowane jako najlepszy i przede wszystkim naturalny sposób żywienia niemowląt. To niewątpliwie najbardziej wartościowy pokarm, który zapewnia zdrowie malucha i jest „inwestycją” na przyszłość. Niestety istnieją substancje, które obecne w naszym najbliższym środowisku, są w stanie do mleka przenikać ze szkodą dla pociechy.
Karmienie piersią jest promowane jako najlepszy i przede wszystkim naturalny sposób żywienia niemowląt. To niewątpliwie najbardziej wartościowy pokarm, który zapewnia zdrowie malucha i jest „inwestycją” na przyszłość. Niestety istnieją substancje, które obecne w naszym najbliższym środowisku, są w stanie do mleka przenikać ze szkodą dla pociechy.
 Historia
Historia
 Stan naszej skóry to łatwy w obserwacji i jednocześnie niezwykle wymierny wskaźnik naszego zdrowia. Niemal zawsze istotne zmiany w jej wyglądzie wynikają z pewnych procesów zachodzących w naszym organizmie. Często są to procesy patologiczne. Należy więc być uważnym i niczego nie lekceważyć. Klucz do sukcesu to spostrzegawczość, dociekliwość i wiedza. By poszerzyć tę ostatnią prześledźmy to, co już wiemy na temat podstawowych zmian skórnych.
Stan naszej skóry to łatwy w obserwacji i jednocześnie niezwykle wymierny wskaźnik naszego zdrowia. Niemal zawsze istotne zmiany w jej wyglądzie wynikają z pewnych procesów zachodzących w naszym organizmie. Często są to procesy patologiczne. Należy więc być uważnym i niczego nie lekceważyć. Klucz do sukcesu to spostrzegawczość, dociekliwość i wiedza. By poszerzyć tę ostatnią prześledźmy to, co już wiemy na temat podstawowych zmian skórnych.



 Trudno dokładnie określić częstość występowania problemów z hemoroidami. Dużo osób wstydzi się tej dolegliwości i nie mówi o niej lekarzowi. Tymczasem szacuje się, że choroba dotyczy blisko połowy z nas na pewnym etapie życia. Nie ma się więc czego wstydzić. Warto leczyć guzki krwawnicze, bo metod terapeutycznych jest naprawdę sporo.
Trudno dokładnie określić częstość występowania problemów z hemoroidami. Dużo osób wstydzi się tej dolegliwości i nie mówi o niej lekarzowi. Tymczasem szacuje się, że choroba dotyczy blisko połowy z nas na pewnym etapie życia. Nie ma się więc czego wstydzić. Warto leczyć guzki krwawnicze, bo metod terapeutycznych jest naprawdę sporo. Leki bez recepty
Leki bez recepty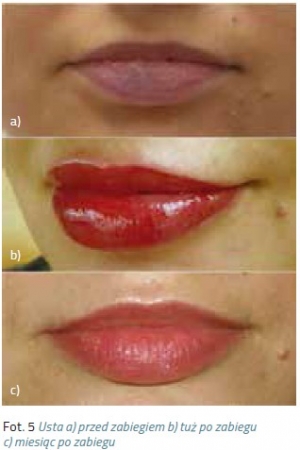
 Makijaż permanentny stał się w ostatnich latach bardzo popularnym zabiegiem. Obecnie oferowany jest w niemal każdym salonie kosmetycznym. Niestety zdarza się, że widujemy krzywe przerysowane brwi, zniekształcone usta czy kreski karykaturalnie wymalowane wokół oka. Coraz częściej do gabinetów kosmetycznych zgłaszają się po pomoc kobiety z powikłaniami po źle wykonanym zabiegu w postaci bliznowców czy rozlanego w skórze pigmentu. Granatowe czy czerwone plamy w miejscu brwi, wyregulowane zbyt agresywnie włosy i łuk przeniesiony nienaturalnie wysoko na czoło, sine usta z konturami wyprowadzonymi poza czerwień wargową, lub migracja pigmentu na powiekach, odstraszają potencjalnych klientów,
Makijaż permanentny stał się w ostatnich latach bardzo popularnym zabiegiem. Obecnie oferowany jest w niemal każdym salonie kosmetycznym. Niestety zdarza się, że widujemy krzywe przerysowane brwi, zniekształcone usta czy kreski karykaturalnie wymalowane wokół oka. Coraz częściej do gabinetów kosmetycznych zgłaszają się po pomoc kobiety z powikłaniami po źle wykonanym zabiegu w postaci bliznowców czy rozlanego w skórze pigmentu. Granatowe czy czerwone plamy w miejscu brwi, wyregulowane zbyt agresywnie włosy i łuk przeniesiony nienaturalnie wysoko na czoło, sine usta z konturami wyprowadzonymi poza czerwień wargową, lub migracja pigmentu na powiekach, odstraszają potencjalnych klientów,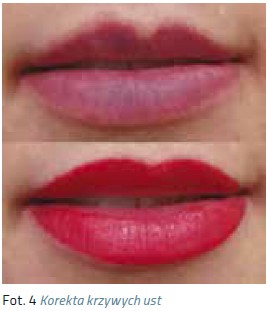
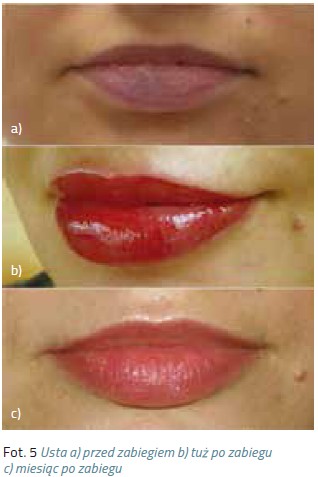 Preparaty nie działają już na barwniki poddane zabiegom laserowym, ponieważ laser rozbija cząsteczki pigmentu, zmieniając ich strukturę. Jeśli więc rozważamy oba zabiegi, to usuwanie preparatem należy przeprowadzić w pierwszej kolejności.
Preparaty nie działają już na barwniki poddane zabiegom laserowym, ponieważ laser rozbija cząsteczki pigmentu, zmieniając ich strukturę. Jeśli więc rozważamy oba zabiegi, to usuwanie preparatem należy przeprowadzić w pierwszej kolejności.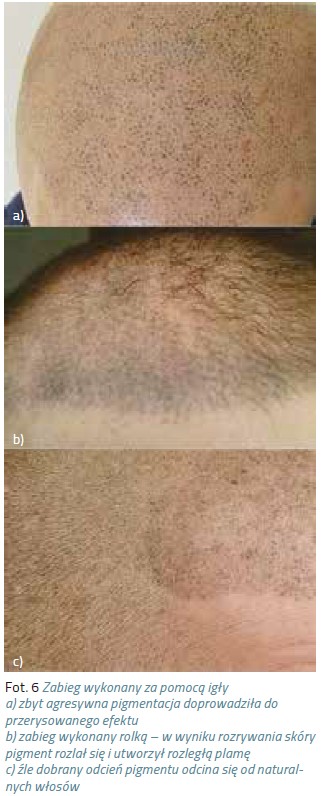 Kamuflaż
Kamuflaż
 Proces starzenia uwidacznia się zmianami w wyglądzie oraz funkcjonowaniu organizmu. Są one najbardziej rozpoznawalne na powierzchni skóry. W efekcie zmniejszania się, a w końcu ustania produkcji kolagenu oraz elastyny ciągłość skóry zostaje przerwana, co przejawia się zmarszczkami o różnym stopniu głębokości, spadkiem stopnia jej elastyczności czy opadaniem np. w okolicach powiek – w przypadku twarzy. Starzenie się skóry właściwej zachodzi głównie w zewnątrzkomórkowej macierzy ECM (Extracellular Matrix), odpowiedzialnej za wytrzymałość na ściskanie i rozciąganie tkanki, stanowiącej medium, poprzez które dostarczane są wszystkie składniki odżywcze do komórek. Jednym ze składników ECM jest kwas hialuronowy. W połączeniu z białkami tworzy elastynę, fibronektyny i kolagen – podstawowe elementy włókniste skóry. Kolagen jest odpowiedzialny za utrzymanie integralności struktury skóry. Fibroblasty produkują prekursory kolagenu. Zmniejszenie liczby fibroblastów w skórze początkuje proces starzenia, powoduje wzrost kolagenazy, która katalizuje rozkład kolagenu. Skutkuje to również zmniejszeniem liczby komórek i rozcieńczaniem włosowatych naczyń krwionośnych. W wyniku tego procesu skóra staje się mniej zwarta strukturalnie, a w efekcie – mniej elastyczna. Konsekwencją tego jest utrata objętości skóry, zmarszczki i atrofia.
Proces starzenia uwidacznia się zmianami w wyglądzie oraz funkcjonowaniu organizmu. Są one najbardziej rozpoznawalne na powierzchni skóry. W efekcie zmniejszania się, a w końcu ustania produkcji kolagenu oraz elastyny ciągłość skóry zostaje przerwana, co przejawia się zmarszczkami o różnym stopniu głębokości, spadkiem stopnia jej elastyczności czy opadaniem np. w okolicach powiek – w przypadku twarzy. Starzenie się skóry właściwej zachodzi głównie w zewnątrzkomórkowej macierzy ECM (Extracellular Matrix), odpowiedzialnej za wytrzymałość na ściskanie i rozciąganie tkanki, stanowiącej medium, poprzez które dostarczane są wszystkie składniki odżywcze do komórek. Jednym ze składników ECM jest kwas hialuronowy. W połączeniu z białkami tworzy elastynę, fibronektyny i kolagen – podstawowe elementy włókniste skóry. Kolagen jest odpowiedzialny za utrzymanie integralności struktury skóry. Fibroblasty produkują prekursory kolagenu. Zmniejszenie liczby fibroblastów w skórze początkuje proces starzenia, powoduje wzrost kolagenazy, która katalizuje rozkład kolagenu. Skutkuje to również zmniejszeniem liczby komórek i rozcieńczaniem włosowatych naczyń krwionośnych. W wyniku tego procesu skóra staje się mniej zwarta strukturalnie, a w efekcie – mniej elastyczna. Konsekwencją tego jest utrata objętości skóry, zmarszczki i atrofia.